Saviez-vous que deux métaux courants, le cuivre et le zinc, jouent un rôle crucial dans notre vie quotidienne, qu'il s'agisse des fils électriques de nos maisons ou de la santé de notre système immunitaire ? Pour les débutants qui souhaitent se familiariser avec ces métaux, il est essentiel de comprendre leurs différences. Physiquement, le cuivre est plus dense et a une teinte rougeâtre distincte, tandis que le zinc est plus léger et argenté. Sur le plan chimique, leur état d'oxydation et leur réactivité varient, ce qui influe sur leurs utilisations industrielles, comme la prédominance du cuivre dans la conductivité électrique et le rôle du zinc dans la galvanisation. Curieux d'en savoir plus sur l'impact de ces métaux sur notre monde et notre corps ?
Introduction
Bref aperçu du cuivre et du zinc
Le cuivre et le zinc sont deux métaux utilisés par l'homme depuis des milliers d'années. Le cuivre, connu pour sa couleur rouge-brun, est couramment utilisé dans les vieilles pièces de monnaie et les câbles électriques. Le zinc, un métal blanc bleuté, est souvent utilisé dans l'acier galvanisé pour les clôtures et les structures extérieures.
Importance de comprendre leurs propriétés et leurs utilisations
Il est essentiel de comprendre les propriétés et les utilisations du cuivre et du zinc. Ces métaux sont omniprésents dans notre vie quotidienne ; par exemple, la conductivité électrique élevée du cuivre le rend essentiel dans l'industrie électronique. Les smartphones, les ordinateurs portables et même le système électrique de votre maison dépendent du câblage en cuivre. Le zinc, avec sa capacité à prévenir la corrosion, est utilisé pour protéger d'autres métaux de la rouille, prolongeant ainsi la durée de vie de nombreux produits métalliques.
En outre, ces deux métaux sont vitaux pour notre santé, car ils jouent un rôle clé dans diverses fonctions de l'organisme. En apprenant à connaître le cuivre et le zinc, nous pouvons mieux apprécier leur importance dans la technologie, l'industrie et notre propre bien-être.
Comparaison des propriétés physiques du cuivre et du zinc
Densité
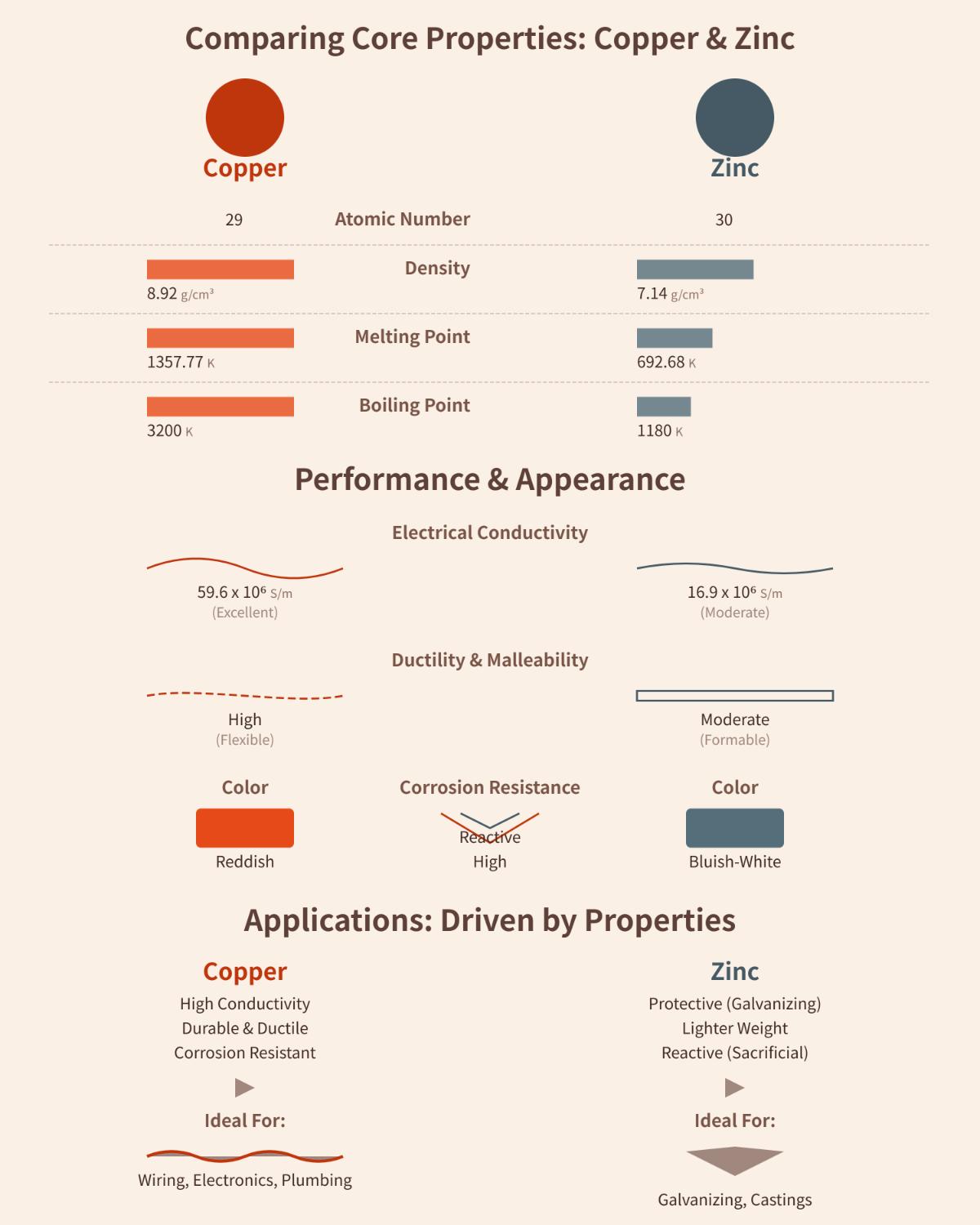
Avec une densité de 8,92 g/cm³, le cuivre est relativement lourd. Cette propriété permet au cuivre d'être utilisé dans des applications où le poids est un avantage, comme dans certaines pièces de machines industrielles. Le zinc, quant à lui, a une densité plus faible de 7,14 g/cm³. Son poids plus faible est avantageux pour les utilisations qui nécessitent une réduction du poids, comme dans certaines structures métalliques légères.
Points de fusion et d'ébullition
Le point de fusion élevé du cuivre (1357,77 K) et son point d'ébullition (2835 K) en font un matériau idéal pour les applications à haute température, telles que les moteurs électriques qui génèrent beaucoup de chaleur. En revanche, le zinc a des points de fusion et d'ébullition plus bas, à 692,68 K et 1180 K respectivement. Cela permet au zinc d'être utilisé dans des processus à basse température, comme dans certains types de soudure.
Conductivité électrique et thermique
Le cuivre est réputé pour son excellente conductivité électrique et thermique. Il est largement utilisé dans le câblage électrique et l'électronique car il peut transférer efficacement l'électricité et la chaleur. Le zinc, quant à lui, présente une conductivité modérée. Bien qu'il ne soit pas aussi efficace que le cuivre, le zinc est souvent utilisé dans des applications où la gestion thermique est moins importante.
Ductilité et malléabilité
Le cuivre est très ductile et malléable. Il peut donc être facilement étiré en fils minces et martelé en feuilles. Ces propriétés font du cuivre un choix populaire dans la production de câbles électriques et d'objets métalliques décoratifs. Le zinc est moins ductile que le cuivre, mais reste façonnable. Il peut être façonné pour des applications spécifiques, comme la fabrication de certains petits composants métalliques.
Dureté
Le cuivre a une dureté Mohs de 3 MPa et une dureté Brinell de 874 MPa, tandis que le zinc est plus doux, avec une dureté Mohs de 2,5 MPa et une dureté Brinell de 412 MPa. La différence de dureté influe sur l'utilisation de ces métaux ; par exemple, le cuivre peut résister à une plus grande usure dans certaines applications que le zinc.
Comportement chimique et états d'oxydation
États d'oxydation du cuivre
Le cuivre (Cu), un métal de transition dont le numéro atomique est 29, a une configuration électronique que l'on peut considérer comme ayant une enveloppe interne remplie et un électron externe. Plus précisément, il s'agit de [Ar] 3d¹⁰ 4s¹. Le cuivre présente principalement deux états d'oxydation : +1 (cuivreux) et +2 (cuivrique). L'état +2 est plus stable et se retrouve dans de nombreux composés. La sous-coquille 3d remplie confère au cuivre sa stabilité et le rend moins réactif que beaucoup d'autres métaux.
Le cuivre a une électronégativité d'environ 1,9 sur l'échelle de Pauling. Cela signifie qu'il attire bien les électrons. Cette propriété permet au cuivre de résister à l'oxydation dans des conditions normales, ce qui accroît sa résistance à la corrosion et sa durabilité. Le cuivre peut également former des complexes de coordination stables, en particulier dans l'état d'oxydation +2. Cela lui permet de participer à une variété de processus biochimiques et d'applications industrielles.
États d'oxydation du zinc
Le zinc (Zn), un métal de post-transition dont le numéro atomique est 30, a une configuration électronique dans laquelle il possède deux électrons externes. C'est [Ar] 3d¹⁰ 4s². Contrairement au cuivre, le zinc présente presque toujours un état d'oxydation +2. Le zinc est plus réactif que le cuivre car il perd facilement ses deux électrons 4s.
Le zinc a une électronégativité plus faible, de l'ordre de 1,65. Sa plus grande réactivité en fait un puissant agent réducteur. Cette propriété permet au zinc de déplacer le cuivre des composés dans les réactions d'oxydoréduction. Par exemple, le zinc peut réagir avec des acides pour libérer de l'hydrogène, alors que le cuivre ne réagit pas de la même manière dans des conditions normales. Bien que le zinc puisse former des complexes de coordination, il n'est pas aussi polyvalent que le cuivre à cet égard.
Différences de réactivité
La différence de réactivité entre le cuivre et le zinc est notable. Le cuivre, avec ses états d'oxydation stables et son électronégativité plus élevée, est moins réactif et plus résistant à la corrosion. Il est donc parfait pour le câblage électrique. Dans les systèmes électriques, la durabilité du cuivre garantit des performances à long terme sans dégradation importante due à l'oxydation. Il est également utilisé dans la plomberie, où il peut supporter les effets de l'eau et d'autres substances pendant de longues périodes.
En revanche, le zinc est plus réactif. Il est couramment utilisé dans la galvanisation pour protéger les structures en fer et en acier. Par exemple, dans les ponts, les revêtements de zinc servent d'anodes sacrificielles. Lorsqu'il est exposé aux éléments, le zinc se corrode en premier au lieu du fer ou de l'acier sous-jacent, ce qui prolonge considérablement la durée de vie du pont.
Résistance à la corrosion
La capacité naturelle du cuivre à résister à l'oxydation et à la corrosion est un avantage majeur. Dans les systèmes de plomberie, sa résistance au ternissement signifie que les tuyaux peuvent être utilisés pendant des décennies sans problème majeur. Il s'agit donc d'un choix fiable pour le transport de l'eau et d'autres fluides.
Le zinc joue un rôle distinct dans la résistance à la corrosion. En tant que métal plus réactif, il est utilisé comme revêtement protecteur. Lorsque le zinc est appliqué sur des métaux comme le fer ou l'acier, il forme une barrière. Cette barrière se corrode de préférence, protégeant ainsi le métal sous-jacent. Dans l'industrie automobile, les pièces revêtues de zinc sont utilisées pour prévenir la rouille et accroître la durabilité du véhicule.
Applications industrielles et pratiques du cuivre et du zinc
Conductivité électrique du cuivre
Le cuivre est très apprécié pour sa capacité exceptionnelle à conduire l'électricité, ce qui en fait un matériau essentiel dans les industries électriques et électroniques. Sa conductivité élevée garantit une transmission efficace des signaux électriques et de l'énergie, ce qui en fait le choix privilégié pour le câblage des maisons, des bâtiments et des équipements électriques. La durabilité du cuivre et sa résistance à la corrosion renforcent encore son adéquation à ces applications, garantissant une fiabilité et des performances à long terme.
Galvanisation au zinc
Le zinc protège les métaux de la corrosion grâce à la galvanisation, qui consiste à recouvrir le fer ou l'acier d'une fine couche de zinc pour éviter la rouille. Cette protection est essentielle dans les secteurs de la construction et de l'automobile, car elle garantit l'intégrité structurelle et la longévité. L'acier galvanisé est largement utilisé dans les structures extérieures, les ponts et les véhicules en raison de sa résistance accrue aux éléments.
Le cuivre dans la plomberie
La résistance du cuivre à la corrosion et sa durabilité en font un matériau idéal pour les systèmes de plomberie. Les tuyaux en cuivre sont largement utilisés pour le transport de l'eau et d'autres fluides dans les bâtiments résidentiels et commerciaux. Les propriétés antimicrobiennes du cuivre contribuent également à réduire le risque de prolifération bactérienne dans les systèmes d'approvisionnement en eau, garantissant ainsi une eau potable plus propre et plus sûre. En outre, la flexibilité et la facilité d'installation du cuivre contribuent à sa popularité dans les applications de plomberie.
Utilisations du laiton (alliage cuivre-zinc)
Le laiton, un alliage de cuivre et de zinc, combine les propriétés bénéfiques des deux métaux, ce qui en fait un matériau polyvalent aux nombreuses applications :
Composition et propriétés du laiton
Le laiton est fabriqué à partir de cuivre et de zinc en différentes quantités, qui peuvent être ajustées pour modifier sa résistance et ses autres propriétés. Cet alliage est connu pour sa solidité, sa facilité d'usinage et sa résistance à la corrosion. La présence de zinc renforce la dureté et la durabilité du laiton, ce qui le rend adapté à un large éventail d'utilisations.
Laiton résistant à la dézincification
Certains types de laiton sont conçus pour résister à la dézincification, un processus au cours duquel le zinc est sélectivement lessivé de l'alliage, ce qui affaiblit l'intégrité structurelle. Le laiton résistant à la dézincification est utilisé dans les applications où l'exposition à des environnements corrosifs est un problème, comme dans les raccords maritimes et les systèmes de plomberie.
Applications courantes du laiton
- Plomberie et transport des fluides: Les raccords, les vannes et les tuyaux en laiton sont largement utilisés dans les systèmes de plomberie en raison de leur résistance à la corrosion et de leur durabilité.
- Électricité et électronique: Le laiton est utilisé dans les connecteurs électriques, les bornes et d'autres composants pour lesquels une bonne conductivité électrique et une bonne résistance à la corrosion sont requises.
- Architecture et construction: L'attrait esthétique du laiton, combiné à sa durabilité, en fait un choix populaire pour les éléments décoratifs tels que les poignées de porte, les cadres de fenêtres et les luminaires.
- Automobile et aérospatiale: Les composants en laiton sont utilisés dans les pièces de moteur, les fixations et d'autres applications critiques dans les industries automobile et aérospatiale en raison de leur résistance et de leur aptitude à la déformation.
Applications de l'oxyde de cuivre et de zinc
L'oxyde de cuivre et de zinc est utilisé dans diverses applications de pointe. Il sert de catalyseur dans les réactions chimiques des processus industriels, contribue à l'électronique de pointe, améliore la technologie des batteries pour un meilleur stockage de l'énergie, détecte les polluants environnementaux à l'aide de capteurs et contribue à l'atténuation de la pollution pour un environnement durable.
Impacts sur la santé et équilibre nutritionnel du cuivre et du zinc
L'équilibre cuivre-zinc dans l'organisme
Le cuivre et le zinc sont des oligo-éléments essentiels qui jouent un rôle crucial dans le corps humain. Le maintien d'un bon équilibre entre ces deux minéraux est vital pour une santé optimale.
Effets du zinc sur l'absorption du cuivre
Le zinc et le cuivre ont une relation antagoniste, ce qui signifie qu'ils sont en concurrence pour l'absorption dans les intestins. Lorsque l'apport en zinc est trop élevé, il peut inhiber l'absorption du cuivre, ce qui peut entraîner une carence.
Problèmes de carence et de toxicité
Carence en cuivre et toxicité
Une carence en cuivre peut entraîner plusieurs problèmes de santé, notamment :
- Anémie : Le cuivre est nécessaire au métabolisme du fer. Une carence peut entraîner une réduction de la production de globules rouges, provoquant fatigue et faiblesse.
- Défauts osseux : Le cuivre est essentiel à la formation de tissus conjonctifs solides. Sa carence peut entraîner des anomalies du squelette, telles que la fragilité des os.
- Dysfonctionnement immunitaire : Le cuivre joue un rôle dans le maintien d'un système immunitaire sain. Une carence peut altérer les réponses immunitaires, ce qui rend la personne plus vulnérable aux infections.
- Anomalies cardiovasculaires : Des niveaux adéquats de cuivre favorisent la santé cardiaque. Une carence en cuivre peut augmenter le risque de maladies cardiovasculaires et entraîner des troubles tels que l'arythmie ou l'insuffisance cardiaque.
À l'inverse, un apport excessif en cuivre peut être toxique et entraîner des problèmes tels que
- Lésions hépatiques : Des niveaux élevés de cuivre peuvent provoquer une toxicité et des lésions du foie, pouvant entraîner des symptômes tels que la jaunisse et des douleurs abdominales.
- Stress oxydatif : Un excès de cuivre peut générer des radicaux libres, entraînant des dommages oxydatifs aux cellules et aux tissus, ce qui peut accélérer le vieillissement et augmenter le risque de cancer.
- Questions neurologiques : La toxicité du cuivre est liée à des troubles neurologiques, tels que les maladies d'Alzheimer et de Parkinson, et peut provoquer des symptômes tels que des pertes de mémoire et des tremblements.
Carence en zinc et toxicité
Une carence en zinc peut entraîner :
- Retard de croissance : Le zinc est essentiel à la croissance et au développement, en particulier chez les enfants. Une carence peut entraîner un retard de croissance et un retard de développement.
- Altération de l'immunité : Le zinc joue un rôle clé dans la fonction immunitaire. Une carence en zinc peut affaiblir la réponse immunitaire et rendre la personne plus vulnérable aux infections.
- Retard de cicatrisation : Le zinc est nécessaire à la croissance et à la réparation des cellules. Une carence en zinc peut ralentir le processus de cicatrisation et prolonger les délais de guérison.
- Déficiences cognitives : Des niveaux adéquats de zinc sont essentiels au fonctionnement normal du cerveau. Une carence peut affecter les capacités cognitives, entraînant des problèmes de concentration et de mémoire.
Un apport excessif en zinc peut être à l'origine de.. :
- Carence en cuivre : Des niveaux élevés de zinc peuvent inhiber l'absorption du cuivre, entraînant une carence secondaire en cuivre.
- Anémie et neutropénie : Une carence secondaire en cuivre due à un excès de zinc peut entraîner une anémie et une diminution du nombre de globules blancs, ce qui peut provoquer de la fatigue et un risque accru d'infection.
Le cuivre et le zinc dans la fonction immunitaire
Le cuivre et le zinc font partie intégrante du système immunitaire. Le cuivre est un composant d'enzymes comme la superoxyde dismutase (SOD) qui protège les cellules des dommages oxydatifs et soutient la production de globules blancs, améliorant ainsi leur capacité à combattre les infections. Le zinc est vital pour le développement et le fonctionnement des cellules immunitaires, contribuant à la production d'anticorps et à l'activité des globules blancs, jouant ainsi un rôle crucial dans la lutte contre les infections et la promotion de la cicatrisation des plaies.
Le maintien d'un apport équilibré en cuivre et en zinc garantit un fonctionnement optimal du système immunitaire, assurant ainsi une protection contre diverses maladies et infections. Un rapport cuivre-zinc approprié est essentiel pour une réponse immunitaire bien régulée et pour le bon fonctionnement des enzymes antioxydantes, qui protègent les cellules des dommages causés par les radicaux libres. Les perturbations de cet équilibre peuvent entraîner une carence ou une toxicité, toutes deux susceptibles d'altérer la fonction immunitaire et l'état de santé général.
Propriétés physiques
Le cuivre et le zinc ont des propriétés physiques distinctes qui influencent leur utilisation dans diverses applications :
- Densité: Le cuivre, dont la densité est de 8,92 g/cm³, est plus lourd que le zinc, dont la densité est de 7,14 g/cm³. Cette différence a une incidence sur leur aptitude à des utilisations spécifiques où le poids est un facteur important.
- Points de fusion: Le cuivre a un point de fusion élevé de 1357,77 K, ce qui le rend adapté aux applications à haute température. En revanche, le zinc a un point de fusion plus bas de 692,68 K, ce qui est avantageux pour les processus nécessitant des températures plus basses.
- Caractéristiques visuelles: Le cuivre est connu pour sa couleur brun-rouge, tandis que le zinc est blanc-bleuâtre. Ces différences visuelles influencent leur utilisation dans des applications décoratives et esthétiques.
Comportement chimique
Les propriétés chimiques du cuivre et du zinc mettent en évidence leur réactivité et leur état d'oxydation :
- États d'oxydation: Le cuivre a généralement des états d'oxydation +1 et +2, tandis que le zinc a presque toujours un état d'oxydation +2.
- Réactivité: Le cuivre est moins réactif, ce qui le rend idéal pour les applications nécessitant durabilité et résistance à la corrosion. La plus grande réactivité du zinc est mise à profit dans les processus de galvanisation pour protéger d'autres métaux de la corrosion.
Applications industrielles
Le cuivre et le zinc sont utilisés à diverses fins industrielles en raison de leurs propriétés uniques :
- Cuivre: L'excellente conductivité électrique du cuivre en fait un matériau idéal pour le câblage électrique, l'électronique et la plomberie, tandis que sa résistance à la corrosion garantit des performances durables.
- Zinc: Principalement utilisé dans la galvanisation, le zinc protège le fer et l'acier de la rouille. Il est également utilisé dans la production de batteries et dans diverses applications médicales en raison de sa biocompatibilité.
Impacts sur la santé
Le cuivre et le zinc sont des oligo-éléments essentiels à la santé humaine :
- Cuivre: Important pour le métabolisme du fer, le fonctionnement du système nerveux et le maintien de la santé cardiovasculaire. Une carence ou un excès peuvent entraîner de graves problèmes de santé.
- Zinc: Le zinc est vital pour la fonction immunitaire, la cicatrisation des plaies et la santé reproductive, une carence entraînant une altération de la croissance et de la réponse immunitaire, et un excès pouvant perturber l'absorption du cuivre.
Durabilité
Ces deux métaux contribuent au développement durable grâce à leur recyclabilité et à leurs avantages pour l'environnement :
- Cuivre: Hautement recyclable, le cuivre favorise l'efficacité énergétique dans les technologies renouvelables.
- Zinc: Bien qu'il soit également recyclable, les avantages du zinc en matière de développement durable sont principalement liés à son rôle dans la protection contre la corrosion.
Questions fréquemment posées
Vous trouverez ci-dessous les réponses à certaines questions fréquemment posées :
Quelles sont les principales différences physiques entre le cuivre et le zinc ?
Le cuivre et le zinc sont deux métaux distincts présentant plusieurs différences physiques. Le cuivre, dont le numéro atomique est 29, est plus dense (8,92 g/cm³) et plus lourd que le zinc, dont le numéro atomique est 30 et la densité 7,14 g/cm³. Le cuivre a un point de fusion (1357,77 K) et un point d'ébullition (3200 K) plus élevés que ceux du zinc (692,68 K) et du zinc (1180 K). Le cuivre convient donc mieux aux applications à haute température.
Le cuivre est connu pour son excellente conductivité électrique, qui est de 59,6 x 10⁶ S/m, ce qui le rend idéal pour le câblage électrique et l'électronique. En revanche, le zinc présente une conductivité modérée de 16,9 x 10⁶ S/m. Le cuivre est également très ductile et malléable, ce qui lui permet d'être facilement étiré en fils et martelé en feuilles, alors que le zinc est moins ductile mais toujours façonnable.
Visuellement, le cuivre a une couleur métallique rougeâtre, alors que le zinc est blanc bleuté. En outre, le cuivre est plus résistant à la corrosion, ce qui le rend approprié pour la plomberie et d'autres applications où la résistance à l'oxydation est importante. Le zinc, quant à lui, est souvent utilisé pour la galvanisation afin de protéger d'autres métaux de la corrosion en raison de sa réactivité.
Ces différences physiques influencent leurs diverses utilisations industrielles et pratiques, le cuivre étant privilégié pour sa conductivité et sa durabilité, et le zinc pour ses propriétés protectrices et son poids plus léger.
En quoi les propriétés chimiques du cuivre et du zinc diffèrent-elles ?
Le cuivre et le zinc ont des propriétés chimiques distinctes qui influencent leur utilisation et leur comportement. Le cuivre, dont le numéro atomique est 29, a une configuration électronique de [Ar] 3d¹⁰ 4s¹, tandis que le zinc, dont le numéro atomique est 30, a une configuration électronique de [Ar] 3d¹⁰ 4s². Cette différence signifie que le cuivre possède des électrons de valence à la fois dans les orbitales 4s et 3d, ce qui lui permet de présenter des états d'oxydation de +1 et +2. Le zinc, quant à lui, présente principalement un état d'oxydation +2, ce qui se traduit par un comportement chimique plus simple et plus prévisible.
L'électronégativité plus élevée du cuivre (1,9 sur l'échelle de Pauling) par rapport au zinc (1,65) signifie qu'il attire plus efficacement les électrons, ce qui contribue à sa résistance à l'oxydation et le rend moins réactif. Le zinc, plus réactif, agit souvent comme agent réducteur et est utilisé dans la galvanisation pour protéger l'acier de la rouille.
Ces différences chimiques rendent le cuivre polyvalent dans la formation de complexes stables et utile dans les applications électriques et de plomberie. La réactivité du zinc et son état d'oxydation unique le rendent idéal pour les revêtements protecteurs et la production de batteries. Comprendre ces propriétés permet de sélectionner le métal approprié pour diverses applications industrielles et sanitaires.
Quelles sont les principales utilisations industrielles du cuivre par rapport au zinc ?
Le cuivre est principalement utilisé dans les industries qui nécessitent une conductivité électrique élevée, telles que l'électronique et les systèmes électriques. Il est essentiel pour le câblage, les circuits imprimés et les appareils électroniques tels que les smartphones et les ordinateurs. Dans la construction de bâtiments, le cuivre est largement utilisé pour la plomberie, le câblage et les systèmes de chauffage, de ventilation et de climatisation. Le secteur des transports fait appel au cuivre pour les composants des véhicules, des avions et des navires. En outre, les propriétés antimicrobiennes du cuivre le rendent précieux dans les applications médicales et les environnements hospitaliers. Il joue également un rôle essentiel dans la production d'énergie renouvelable, en particulier pour les éoliennes et les panneaux solaires.
Le zinc, quant à lui, est apprécié pour sa résistance à la corrosion et est couramment utilisé pour galvaniser le fer et l'acier afin de les protéger de la rouille. Il forme des alliages solides, comme le laiton, qui sont utilisés dans les instruments de musique, la quincaillerie et les articles de décoration. Le zinc joue également un rôle important dans la production de piles, en particulier les piles zinc-air et zinc-carbone. Dans le domaine de la santé, le zinc joue un rôle dans la cicatrisation des plaies et la fonction immunitaire, et il est utilisé dans certaines applications médicales telles que les implants chirurgicaux.
Comment le zinc affecte-t-il l'absorption du cuivre dans le corps humain ?
Le zinc affecte l'absorption du cuivre dans le corps humain principalement en interférant avec son absorption dans les intestins. Les deux minéraux partagent des voies d'absorption similaires, et des niveaux élevés de zinc peuvent entraîner une inhibition compétitive, réduisant l'efficacité de l'absorption du cuivre dans la circulation sanguine. En outre, le zinc stimule la production d'une protéine appelée métallothionéine dans les cellules intestinales, qui lie fortement le cuivre et l'empêche de pénétrer dans la circulation. Le cuivre lié est finalement excrété, ce qui peut entraîner une carence en cuivre si l'apport en zinc est excessivement élevé. Ce déséquilibre peut entraîner des symptômes tels que l'anémie, des problèmes neurologiques et une altération de la fonction immunitaire, car le cuivre est essentiel à divers processus physiologiques. Il est donc essentiel de maintenir un apport équilibré de ces deux minéraux pour prévenir les problèmes de santé.
Qu'est-ce que le laiton et comment le zinc affecte-t-il ses propriétés ?
Le laiton est un alliage composé principalement de cuivre et de zinc. En règle générale, le cuivre représente environ 55% à 95% de l'alliage, tandis que le zinc constitue 5% à 45%, bien que ces proportions puissent varier en fonction des propriétés souhaitées. Le zinc influence considérablement les propriétés du laiton en augmentant sa résistance et sa dureté, ce qui rend l'alliage plus résistant et plus durable. En outre, une teneur élevée en zinc fait passer la couleur du laiton d'une teinte douce et dorée à un ton plus argenté ou jaune terne. Le zinc influe également sur la malléabilité du laiton ; les alliages à forte teneur en zinc sont moins malléables et doivent souvent être travaillés à chaud. En outre, si le laiton présente généralement une bonne résistance à la corrosion grâce au cuivre, le zinc peut affecter cette propriété, en particulier dans les environnements marins où une dézincification peut se produire, entraînant une lixiviation sélective du zinc et un affaiblissement de l'alliage. Il est essentiel de comprendre l'équilibre entre le cuivre et le zinc pour optimiser le laiton dans diverses applications, qu'il s'agisse d'objets décoratifs ou d'utilisations industrielles.
