Vous êtes-vous déjà demandé comment fonctionnent les piles de tous les jours ou comment les métaux se protègent de la corrosion ? La réponse se trouve dans le monde fascinant des réactions d'oxydoréduction. Ce guide pas à pas lèvera le voile sur les mystères des réactions d'oxydoréduction du zinc et du cuivre, idéal pour les débutants désireux de comprendre ces processus chimiques fondamentaux. Nous commencerons par explorer les concepts de base de l'oxydation et de la réduction, puis nous plongerons dans les spécificités de la réaction du zinc et du cuivre, y compris l'équation qui la régit et le mécanisme détaillé qui la sous-tend. En cours de route, nous mettrons en évidence les applications pratiques et fournirons des conseils simples pour équilibrer les équations d'oxydoréduction. Prêt à vous lancer dans ce voyage chimique ? C'est parti !
Oxydation et réduction : Concepts de base
Concepts de base de l'oxydation et de la réduction
Il est essentiel de comprendre les notions d'oxydation et de réduction pour appréhender les réactions d'oxydoréduction. Décortiquons ces processus fondamentaux étape par étape.
Qu'est-ce que l'oxydation ?
L'oxydation est le processus par lequel une substance perd des électrons. Cette perte d'électrons entraîne une augmentation de l'état d'oxydation de la substance. L'oxydation peut se produire de différentes manières, par exemple lorsque le fer réagit avec l'oxygène pour former de la rouille (oxyde de fer) :
- Ajout d'oxygène: Lorsqu'une substance se combine à l'oxygène, elle perd souvent des électrons. Par exemple, lorsque le fer réagit avec l'oxygène pour former de la rouille (oxyde de fer), il subit une oxydation.
- Élimination de l'hydrogène: Parfois, la perte d'atomes d'hydrogène indique une oxydation. Par exemple, lorsque l'éthanol est oxydé en acétaldéhyde, des atomes d'hydrogène sont éliminés.
- Perte d'électrons: La forme la plus simple d'oxydation est la perte directe d'électrons. Par exemple, lorsque le métal zinc (Zn) est transformé en ions zinc (Zn²⁺), il perd deux électrons.
Qu'est-ce que la réduction ?
La réduction est le contraire de l'oxydation et implique qu'une substance gagne des électrons, ce qui diminue son état d'oxydation. La réduction peut se produire par le biais de plusieurs mécanismes :
- Ajout d'hydrogène: Lorsqu'une substance gagne des atomes d'hydrogène, elle est réduite. Par exemple, lorsque l'éthène est transformé en éthane, des atomes d'hydrogène sont ajoutés.
- Élimination de l'oxygène: Dans certaines réactions, l'élimination d'atomes d'oxygène signifie une réduction. Par exemple, lorsque l'oxyde de cuivre(II) (CuO) est réduit en cuivre métal (Cu), les atomes d'oxygène sont éliminés.
- Gain d'électrons: Le gain direct d'électrons est la forme la plus simple de réduction. Par exemple, lorsque les ions cuivre (Cu²⁺) gagnent des électrons pour former du cuivre métal (Cu), ils sont réduits.
Agents oxydants et réducteurs
Dans toute réaction d'oxydoréduction, il y a deux acteurs essentiels : l'agent oxydant et l'agent réducteur.
- Agent oxydant: Il s'agit de la substance qui accepte les électrons et qui est elle-même réduite. Les agents oxydants courants sont l'oxygène, les halogènes (comme le chlore) et des composés comme le permanganate de potassium (KMnO₄).
- Agent réducteur: Il s'agit de la substance qui donne des électrons et qui est elle-même oxydée. Les agents réducteurs les plus courants sont les métaux comme le zinc et le fer, ainsi que les non-métaux comme le carbone et l'hydrogène.
Identifier l'oxydation et la réduction dans les réactions
Pour identifier l'oxydation et la réduction dans une réaction chimique, commencez par attribuer des états d'oxydation à tous les éléments des réactifs et des produits afin de suivre le transfert d'électrons. Cela vous aidera à
- Déterminer les états d'oxydation: Attribuez des états d'oxydation à tous les éléments des réactifs et des produits. Cela vous aidera à suivre le gain et la perte d'électrons.
- Identifier le transfert d'électrons: Recherchez les changements d'état d'oxydation. Une augmentation de l'état d'oxydation indique une oxydation, tandis qu'une diminution indique une réduction.
- Reconnaître les agents: Identifier les substances oxydées et réduites, puis déterminer les agents oxydants et réducteurs correspondants.
En comprenant ces concepts de base, vous pourrez analyser et comprendre des réactions d'oxydoréduction plus complexes impliquant divers éléments et composés.
Comprendre les réactions d'oxydoréduction
Concepts de base des réactions d'oxydoréduction
Les réactions d'oxydoréduction, abréviation de réduction-oxydation, sont des processus chimiques fondamentaux impliquant le transfert d'électrons entre des substances. Il est essentiel de comprendre ces réactions pour saisir comment les diverses réactions chimiques se produisent et sont équilibrées.
Oxydation et réduction
Dans une réaction d'oxydoréduction, deux processus clés ont lieu simultanément : l'oxydation et la réduction.
Oxydation: Il s'agit de la perte d'électrons par une molécule, un atome ou un ion. Lorsqu'une substance subit une oxydation, son état d'oxydation augmente. Par exemple, lorsque le zinc (Zn) perd des électrons pour former des ions zinc (Zn²⁺), il est oxydé.
Réduction: Il s'agit du gain d'électrons par une molécule, un atome ou un ion. Lorsqu'une substance subit une réduction, son état d'oxydation diminue. Par exemple, lorsque les ions cuivre (Cu²⁺) gagnent des électrons pour former du cuivre métal (Cu), ils sont réduits.
Agents oxydants et réducteurs
Dans toute réaction d'oxydoréduction, il y a deux acteurs principaux : l'agent oxydant et l'agent réducteur :
Agent oxydant: La substance qui gagne des électrons et qui est réduite. Elle provoque l'oxydation d'une autre substance. Par exemple, les ions cuivre (Cu²⁺) agissent comme agent oxydant lorsqu'ils gagnent des électrons sur le zinc.
Agent réducteur: La substance qui perd des électrons et qui est oxydée. Elle provoque la réduction d'une autre substance. Le zinc (Zn) agit comme agent réducteur lorsqu'il donne des électrons aux ions cuivre.
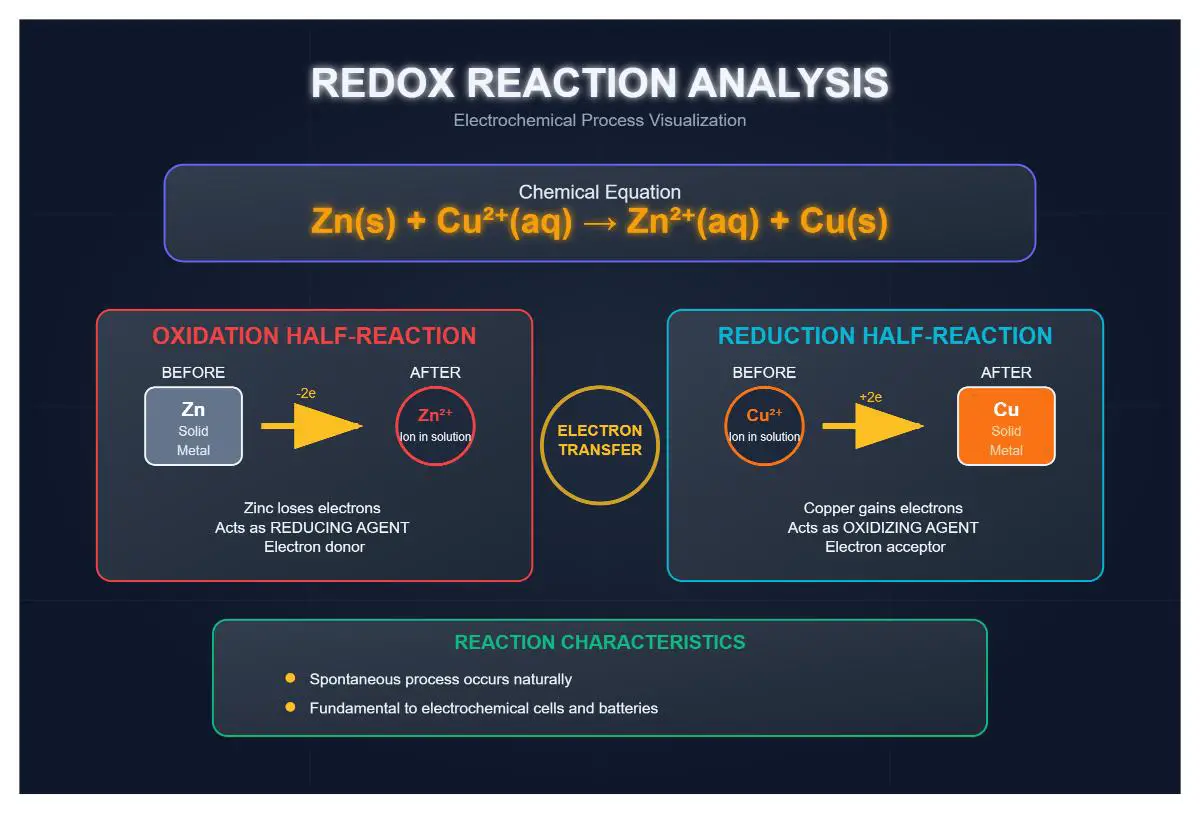
Exemple de réaction d'oxydoréduction : Zinc et cuivre
Un exemple bien connu de réaction d'oxydoréduction est celui du zinc qui réagit avec des ions de cuivre en solution :
Dans cette réaction :
- Oxydation: Le zinc (Zn) perd deux électrons pour former des ions zinc (Zn²⁺).
- Réduction: Les ions cuivre (Cu²⁺) gagnent deux électrons pour former du cuivre métal (Cu).
Étapes pour comprendre les réactions d'oxydoréduction
Pour bien comprendre et analyser les réactions d'oxydoréduction, il faut commencer par déterminer l'état d'oxydation de tous les éléments impliqués dans la réaction, ce qui permet de suivre le transfert d'électrons. Pour la réaction zinc-cuivre :
- Le zinc commence avec un état d'oxydation de 0 et finit avec +2.
- Le cuivre commence par un état d'oxydation de +2 et se termine par 0.
Identifier les éléments qui sont oxydés (perte d'électrons) et ceux qui sont réduits (gain d'électrons) en fonction des changements de leur état d'oxydation :
- Le zinc est oxydé (0 à +2).
- Le cuivre est réduit (+2 à 0).
À partir des processus d'oxydation et de réduction identifiés, déterminez les agents oxydants et réducteurs :
- Le zinc (Zn) est l'agent réducteur car il donne des électrons.
- Les ions cuivre (Cu²⁺) sont l'agent oxydant car ils acceptent les électrons.
Points clés à retenir
Rappelez-vous que les réactions d'oxydoréduction impliquent à la fois une oxydation (perte d'électrons) et une réduction (gain d'électrons). La substance oxydée est l'agent réducteur, tandis que la substance réduite est l'agent oxydant. Le suivi du transfert d'électrons et des changements d'état d'oxydation est essentiel pour comprendre ces réactions.
En maîtrisant ces concepts de base, vous pourrez comprendre, analyser et équilibrer efficacement les réactions d'oxydoréduction dans divers contextes chimiques.
Principaux matériaux : Zinc et cuivre
Importance du zinc et du cuivre dans les réactions d'oxydoréduction
Le zinc et le cuivre sont des éléments essentiels dans de nombreuses réactions d'oxydoréduction, en particulier dans les processus électrochimiques. Comprendre le rôle de ces métaux peut aider à saisir les concepts plus larges de la chimie redox.
Zinc : l'agent réducteur
Le zinc (Zn), élément chimique de numéro atomique 30, est largement reconnu pour son rôle d'agent réducteur dans les réactions d'oxydoréduction, où il donne des électrons à d'autres substances et s'oxyde lui-même. Voici quelques propriétés et utilisations clés du zinc :
- Donneur d'électrons: Dans les réactions d'oxydoréduction, les atomes de zinc perdent deux électrons pour former des ions zinc (Zn²⁺). C'est cette perte d'électrons qui constitue l'oxydation.
- Abondance et applications: Le zinc est le 24e élément le plus abondant dans l'écorce terrestre. Il est largement utilisé pour galvaniser l'acier afin d'éviter la rouille.
- Propriétés physiques: Le zinc est un métal blanc bleuté qui est cassant à température ambiante mais qui devient malléable lorsqu'il est chauffé.
Le cuivre : L'agent oxydant
Le cuivre (Cu), dont le numéro atomique est 29, agit comme un agent oxydant dans les réactions d'oxydoréduction en acceptant les électrons d'autres substances et en étant réduit. Voici quelques informations essentielles sur le cuivre :
- Accepteur d'électrons: Dans les réactions d'oxydoréduction, les ions cuivre (Cu²⁺) gagnent des électrons pour former du cuivre métal (Cu). Ce gain d'électrons constitue la réduction.
- Conductivité et utilisations: Le cuivre est très conducteur et est largement utilisé dans le câblage électrique, la plomberie et la production d'alliages tels que le bronze.
- Propriétés physiques: Le cuivre est un métal brun rougeâtre connu pour sa grande conductivité thermique et électrique.
Zinc et cuivre dans les réactions d'oxydoréduction
Lorsque le zinc et le cuivre participent à une réaction d'oxydoréduction, ils démontrent clairement leur rôle de réducteur et d'oxydant, respectivement, par le transfert d'électrons. Explorons le mécanisme de la réaction étape par étape :
Mécanisme de réaction étape par étape
Configuration initiale de la réaction:
Zn(s)+Cu2+(aq)→Zn2+(aq)+Cu(s)- Zinc (Zn) sous forme solide réagit avec les ions cuivre (Cu²⁺) dans une solution aqueuse.
Demi-réaction d'oxydation:
- Les atomes de zinc perdent deux électrons et sont oxydés en ions zinc :
Zn(s)→Zn2+(aq)+2e-
- Les atomes de zinc perdent deux électrons et sont oxydés en ions zinc :
Réduction Demi-réaction:
- Les ions cuivre gagnent deux électrons et sont réduits en cuivre solide :
Cu2+(aq)+2e-→Cu(s)
- Les ions cuivre gagnent deux électrons et sont réduits en cuivre solide :
Combinaison de demi-réactions:
- La réaction d'oxydoréduction globale équilibrée peut s'écrire comme suit :
Zn(s)+Cu2+(aq)→Zn2+(aq)+Cu(s)
- La réaction d'oxydoréduction globale équilibrée peut s'écrire comme suit :
Applications pratiques
La réaction d'oxydoréduction zinc-cuivre a des applications pratiques, notamment dans les cellules galvaniques qui convertissent l'énergie chimique en énergie électrique, et dans les processus de galvanisation où le zinc protège les métaux comme le fer de la corrosion en agissant comme une anode sacrificielle.
Mécanisme d'oxydoréduction du zinc et du cuivre
Comprendre le zinc et le cuivre dans les réactions d'oxydoréduction
Le zinc et le cuivre sont des éléments importants dans les réactions d'oxydoréduction, où le zinc agit comme agent réducteur et le cuivre comme agent oxydant. Découvrons étape par étape le mécanisme de leur réaction d'oxydoréduction.
La configuration de la réaction
Lorsque le métal zinc (Zn) est placé dans une solution contenant des ions cuivre(II) (Cu²⁺), une réaction d'oxydoréduction spontanée se produit. Celle-ci peut être représentée par l'équation chimique globale suivante :
Demi-réactions d'oxydation et de réduction
Demi-réaction d'oxydation
Dans cette réaction, le zinc subit une oxydation. Les atomes de zinc perdent des électrons pour former des ions zinc :
Ici, le zinc (Zn) commence avec un état d'oxydation de 0 et est oxydé en Zn²⁺, ce qui augmente son état d'oxydation à +2.
Réduction Demi-réaction
Les ions cuivre(II) subissent une réduction. Ils gagnent des électrons pour former du cuivre métal :
Dans cette demi-réaction, les ions cuivre (Cu²⁺) avec un état d'oxydation de +2 gagnent des électrons pour former du cuivre métal (Cu) avec un état d'oxydation de 0.
Mécanisme de réaction détaillé
Lorsque le zinc est immergé dans une solution contenant des ions Cu²⁺, la réaction commence à la surface du zinc. Les atomes de zinc perdent chacun deux électrons, devenant des ions Zn²⁺, et ces électrons sont transférés aux ions Cu²⁺ de la solution.
Formation des produits
Les ions Zn²⁺ se dissolvent dans la solution, tandis que les ions Cu²⁺ gagnent les électrons perdus par le zinc, formant un métal cuivreux solide qui se dépose sur la surface du zinc.
Observations pendant la réaction
- Corrosion du zinc: La bande de zinc s'assombrit et se corrode en perdant des électrons et en formant des ions Zn²⁺.
- Dépôt de cuivre: Du cuivre solide s'accumule sur la bande de zinc, apparaissant sous la forme d'une couche brun rougeâtre.
- Changement de couleur: La couleur bleue de la solution de sulfate de cuivre(II) s'estompe à mesure que les ions Cu²⁺ sont réduits en cuivre métal.
Spontanéité et utilisation pratique
Cette réaction d'oxydoréduction est spontanée, c'est-à-dire qu'elle se produit sans apport d'énergie extérieure. Le zinc est plus réactif que le cuivre, ce qui en fait un meilleur donneur d'électrons. Cette propriété est utilisée dans les cellules galvaniques, où l'énergie chimique des réactions d'oxydoréduction est convertie en énergie électrique.
Applications pratiques des réactions d'oxydoréduction du zinc et du cuivre
Applications pratiques des réactions d'oxydoréduction du zinc et du cuivre
La compréhension des applications pratiques des réactions d'oxydoréduction du zinc et du cuivre peut fournir des indications précieuses sur la manière dont ces processus chimiques sont utilisés dans diverses industries et dans la vie de tous les jours.
Piles et batteries galvaniques
L'une des principales applications des réactions d'oxydoréduction du zinc et du cuivre se trouve dans les piles galvaniques, communément appelées batteries, qui convertissent l'énergie chimique en énergie électrique. Dans une cellule galvanique, le zinc sert d'anode où se produit l'oxydation, et le cuivre sert de cathode où se produit la réduction. Une solution électrolytique contenant des ions facilite le flux d'électrons, permettant au zinc de perdre des électrons (oxydation) et de les libérer dans le circuit externe, tandis que les ions de cuivre gagnent des électrons (réduction), complétant ainsi le circuit.
Le flux d'électrons génère un courant électrique qui peut être exploité pour alimenter des appareils électroniques.
Protection contre la corrosion (galvanisation)
Le rôle du zinc en tant qu'agent réducteur est utilisé dans la galvanisation, un processus qui protège le fer et l'acier de la rouille en les recouvrant d'une couche de zinc. Ce procédé est réalisé par des méthodes telles que la galvanisation à chaud. Le zinc se corrode préférentiellement, empêchant le métal sous-jacent de s'oxyder et de rouiller, ce qui prolonge la durabilité et la résistance des structures métalliques aux facteurs environnementaux.
Démonstrations pédagogiques
La réaction d'oxydoréduction zinc-cuivre est couramment utilisée dans les établissements d'enseignement pour démontrer les principes de base de la chimie d'oxydoréduction. Les élèves observent la réaction entre le zinc et la solution de sulfate de cuivre, notant les changements visuels tels que la décoloration et le dépôt de cuivre. Cette réaction illustre l'oxydation, la réduction et le flux d'électrons, ce qui aide les enseignants à expliquer les processus d'oxydoréduction et les cellules galvaniques.
Réactions d'oxydoréduction exothermiques
Le zinc peut réagir avec l'oxyde de cuivre(II) dans une réaction d'oxydoréduction exothermique, qui libère de la chaleur et est utile pour démontrer des processus chimiques énergétiques. Dans cette réaction, la poudre de zinc est mélangée à l'oxyde de cuivre(II), produisant de l'oxyde de zinc et du cuivre métal tout en libérant de l'énergie thermique. Cette réaction met en évidence la dynamique énergétique des réactions d'oxydoréduction et de la réduction des oxydes métalliques.
Utilisations industrielles
Les réactions d'oxydoréduction du zinc et du cuivre ont plusieurs applications industrielles, notamment la galvanoplastie, où le cuivre est déposé sur divers substrats à l'aide de méthodes électrochimiques impliquant des réactions d'oxydoréduction. Elles sont également utilisées dans les processus d'extraction des métaux, en tirant parti de la réactivité du zinc, et dans la synthèse chimique pour produire des composés et des matériaux utilisés dans diverses industries.
En explorant ces applications pratiques, nous comprenons mieux l'importance et la polyvalence des réactions d'oxydoréduction du zinc et du cuivre en chimie théorique et appliquée.
Équilibrer les équations des réactions d'oxydoréduction
Équilibrer les équations des réactions d'oxydoréduction peut sembler décourageant au premier abord, mais une approche systématique permet de simplifier les choses.
Étape 1 : Identifier les demi-réactions d'oxydation et de réduction
Déterminez d'abord quelles sont les substances oxydées et réduites. Notez séparément les demi-réactions d'oxydation et de réduction. Prenons l'exemple du zinc et du cuivre :
Oxydation (zinc) :
Zn⟶Zn2++2e-
Le zinc perd des électrons, il est donc oxydé.Réduction (cuivre) :
Cu2++2e-⟶Cu
Les ions cuivre gagnent des électrons et sont donc réduits.
Étape 2 : Équilibrer les atomes à l'exception de l'oxygène et de l'hydrogène
Assurez-vous que tous les atomes, à l'exception de l'oxygène et de l'hydrogène, sont équilibrés dans chaque demi-réaction. Dans l'exemple du zinc et du cuivre, les deux demi-réactions sont déjà équilibrées pour les atomes de zinc et de cuivre.
Étape 3 : Équilibrer les atomes d'oxygène et d'hydrogène
Pour les réactions se produisant dans des solutions acides, équilibrer les atomes d'oxygène en ajoutant (H2O) (eau) et équilibrer les atomes d'hydrogène en ajoutant des molécules (H+) (ions hydrogène).
Dans notre exemple du zinc et du cuivre, il n'y a pas d'atomes d'oxygène ou d'hydrogène à équilibrer dans les demi-réactions fournies. Toutefois, dans le cas de réactions plus complexes, il convient de suivre ces étapes :
- Ajouter (H2O) pour équilibrer les atomes d'oxygène.
- Ajouter (H+) pour équilibrer les atomes d'hydrogène.
Étape 4 : Équilibrer les charges avec les électrons
Assurez-vous que les charges des deux côtés de chaque demi-réaction sont égales en ajoutant des électrons (e–).
Oxydation (zinc) :
Zn⟶Zn2++2e-
Le zinc est déjà équilibré avec 2 électrons.Réduction (cuivre) :
Cu2++2e-⟶Cu
Le cuivre est également équilibré avec 2 électrons.
Étape 5 : Combiner les demi-réactions
Fusionnez maintenant les deux demi-réactions, en vous assurant que les électrons perdus lors de l'oxydation correspondent à ceux gagnés lors de la réduction, afin qu'ils s'annulent mutuellement.
Les deux côtés de l'équation sont maintenant équilibrés pour la masse et la charge.
Principales considérations
Conditions acides et conditions basiques :
Pour les solutions acides, équilibrer avec (H+) et (H2O). Pour les solutions basiques, utiliser (OH–) et (H2O).Transfert d'électrons :
S'assurer que le nombre d'électrons perdus lors de l'oxydation est égal au nombre d'électrons gagnés lors de la réduction.
Exemple pratique
Considérons la réaction d'oxydoréduction du métal zinc déplaçant les ions cuivre d'une solution de sulfate de cuivre (CuSO4):
Cette réaction est déjà équilibrée, le zinc étant oxydé et les ions de cuivre réduits. Il ne reste plus d'ions (H+) ou (H2O), ce qui permet de l'équilibrer facilement.
Liste de contrôle pour la vérification
Pour vérifier que l'équation de la réaction d'oxydoréduction est équilibrée :
- Vérifiez que le nombre d'atomes de chaque élément est le même des deux côtés de l'équation.
- Veillez à ce que la charge totale soit la même des deux côtés.
- Confirmer que les électrons perdus sont égaux aux électrons gagnés.
En suivant ces étapes, vous pouvez systématiquement équilibrer les équations de réaction d'oxydoréduction, en veillant à ce que la masse et la charge soient conservées.
Questions fréquemment posées
Vous trouverez ci-dessous les réponses à certaines questions fréquemment posées :
Quelle est l'équation de la réaction d'oxydoréduction entre le zinc et le cuivre ?
La réaction d'oxydoréduction du zinc et du cuivre est représentée par l'équation :
Zn(s) + Cu²⁺(aq) → Zn²⁺(aq) + Cu(s)
Dans cette réaction, le métal zinc (Zn) réagit avec les ions cuivre(II) (Cu²⁺) en solution. Le zinc subit une oxydation, c'est-à-dire qu'il perd des électrons et forme des ions zinc (Zn²⁺). Simultanément, les ions cuivre(II) subissent une réduction en gagnant des électrons et en formant du cuivre solide (Cu). Ce processus implique un transfert d'électrons, ce qui en fait une réaction d'oxydoréduction (réduction-oxydation). Le zinc agit comme agent réducteur, tandis que les ions de cuivre agissent comme agent oxydant. Cette réaction est spontanée et démontre les principes de base des réactions d'oxydoréduction en électrochimie.
Comment se produit la réaction d'oxydoréduction du zinc et du cuivre ?
La réaction d'oxydoréduction du zinc et du cuivre se produit lorsque le métal zinc réagit avec une solution de sulfate de cuivre(II). Dans cette réaction, le zinc subit une oxydation, c'est-à-dire qu'il perd des électrons et devient des ions zinc (Zn²⁺). Simultanément, les ions cuivre (Cu²⁺) présents dans la solution gagnent des électrons par réduction et deviennent du cuivre métal solide (Cu).
La réaction globale peut être décrite par l'équation suivante :
Dans ce cas, le zinc agit comme agent réducteur, en donnant des électrons, tandis que les ions de cuivre agissent comme agent oxydant, en acceptant des électrons. Ce transfert d'électrons est spontané en raison de la plus grande réactivité du zinc par rapport au cuivre. En conséquence, vous observerez le métal zinc s'assombrir à mesure que le cuivre se dépose sur sa surface et la couleur bleue de la solution de sulfate de cuivre s'estomper. Cette réaction est fondamentale dans des applications telles que les cellules galvaniques, où le flux d'électrons génère de l'énergie électrique.
Pourquoi le zinc est-il utilisé dans les réactions d'oxydoréduction avec le cuivre ?
Le zinc est utilisé dans les réactions d'oxydoréduction avec le cuivre en raison de sa plus grande réactivité par rapport au cuivre. Dans une réaction d'oxydoréduction, une substance perd des électrons (oxydation) tandis qu'une autre en gagne (réduction). Le zinc agit comme agent réducteur, c'est-à-dire qu'il donne des électrons et s'oxyde en Zn²⁺. Les ions cuivre (Cu²⁺), quant à eux, agissent en tant qu'agent oxydant, acceptant les électrons du zinc et se réduisant en cuivre métallique (Cu). Cette différence de réactivité permet au zinc de déplacer efficacement les ions cuivre d'une solution, ce qui fait avancer la réaction. En outre, la plus grande réactivité du zinc le rend utile dans des applications pratiques telles que la galvanisation, où il sert d'anode sacrificielle pour protéger d'autres métaux de la corrosion.
Quelles sont les applications pratiques des réactions d'oxydoréduction du zinc et du cuivre ?
Les réactions d'oxydoréduction du zinc et du cuivre ont plusieurs applications pratiques dans divers domaines. Dans le domaine de l'énergie, ces réactions sont fondamentales dans les cellules galvaniques, comme la cellule Daniell, qui génèrent de l'électricité en permettant aux électrons de circuler entre les électrodes de zinc et de cuivre. Ce principe est utilisé dans les piles.
Dans l'industrie, le zinc sert d'anode sacrificielle dans la protection contre la corrosion, en particulier dans les processus de galvanisation. La plus grande réactivité du zinc fait qu'il se corrode en premier, protégeant ainsi les métaux moins réactifs comme le cuivre. En outre, la capacité du zinc à donner des électrons est cruciale pour réduire les oxydes métalliques lors de l'extraction et du raffinage des métaux, ainsi que pour le traitement des eaux usées.
Dans le domaine de l'éducation, la réaction d'oxydoréduction zinc-cuivre est une démonstration courante pour enseigner les principes de base de la chimie et de l'électrochimie. Enfin, les applications environnementales comprennent l'utilisation des réactions d'oxydoréduction pour transformer les polluants nocifs en formes moins nocives, contribuant ainsi à la dépollution. Ces diverses applications soulignent l'importance des réactions d'oxydoréduction du zinc et du cuivre dans les contextes technologiques et environnementaux.
Comment équilibrer facilement les équations de réactions d'oxydoréduction ?
Pour équilibrer facilement les équations des réactions d'oxydoréduction, en particulier pour le zinc et le cuivre, suivez les étapes suivantes :
Séparer en demi-réactions: Diviser la réaction globale en demi-réactions d'oxydation (perte d'électrons) et de réduction (gain d'électrons). Par exemple :
- Oxydation : Zn⟶Zn2++2e-
- Réduction : Cu2++2e-⟶Cu
Équilibre des atomes: Veillez à ce que tous les atomes, à l'exception de l'oxygène et de l'hydrogène, soient équilibrés dans chaque demi-réaction. Étant donné que les réactions du zinc et du cuivre n'impliquent généralement pas d'oxygène ou d'hydrogène, il convient de se concentrer sur l'équilibre des atomes de zinc et de cuivre.
Charge de la balance: Ajouter des électrons d'un côté de chaque demi-réaction pour équilibrer la charge. Pour l'oxydation du zinc, les électrons apparaissent du côté du produit, et pour la réduction du cuivre, ils apparaissent du côté du réactif.
Équilibrer les électrons: Multipliez les demi-réactions de manière à ce que le nombre d'électrons perdus lors de l'oxydation soit égal au nombre d'électrons gagnés lors de la réduction. Dans cet exemple, les deux demi-réactions impliquent 2 électrons, donc aucune multiplication n'est nécessaire.
Combiner les demi-réactions: Additionnez les demi-réactions, en annulant les électrons et toute autre espèce apparaissant des deux côtés. L'équation équilibrée pour le zinc et le cuivre est la suivante :
Zn+Cu2+⟶Zn2++Cu
En suivant ces étapes, les atomes et les charges sont équilibrés, ce qui rend le processus simple, même pour les débutants.
